重庆市某传染病医院2011年-2014年HIV/RNA监测结果分析
赵攀1,王静2,白艳3,唐德谊1,黄成瑜4(400036重庆,重庆市公共卫生医疗救治中心:科教科1,检验科2,,项目办3,感染科门诊4 400036)
[摘要] 目的 通过对重庆市某传染病医院2011年至2014年初次抗病毒治疗的HIV感染者和艾滋病患者定期进行HIV病毒载量监测,并对监测结果进行分析,找出HIV病毒监测与加强患者治疗依从性的关系。方法 选取2011年1月至2014年1月在重庆市公共卫生医疗救治中心艾滋病门诊就诊的准备予以抗病毒治疗的HIV感染者和艾滋病患者1500例纳入研究对象,其中800例作为对照组予以初次HIV/RNA监测,然后予以每年免费监测一次;另外700例作为观察组,除初次HIV/RNA监测外,第1, 6,12,18个月(每半年1次)分别1次HIV/RNA监测,观察两组患者服药依从性、病毒载量、CD4-T淋巴细胞、卡罗斯基积分等变化。结果 对照组治愈率41.9%(18/43),病情逆转率18.6%(8/43),死亡率16.2%(7/43);观察组治愈率83.3%(35/42),病情逆转率4.8%(2/42)并发症发生率28.6%(12/42),死亡率2.3%(1/42)。两组治愈率、死亡率比较有统计学显著差异(P<0.01),病情逆转率比较有统计学差异(P<0.05)。结论 HIV病毒载量监测可以作为增强艾滋病患者治疗依从性的手段,短期、定时实施HIV病毒载量监测是提高治疗依从性的关键。
[中图法分类号] [文献标志码] A
[基金项目]重庆市卫生计生委医学科研建设项目(项目编号:2015ZBXM023);中国爱之关怀项目基金
[通信作者]黄成瑜,E-mail:421847867@qq.com
人类免疫缺陷病毒(HIV-Ⅰ)感染始于急性系统性感染,其特征是外周血CD4+T细胞计数快速、大幅度下降,随着HIV感染自然病程的进展,在急性期后进入3至10年的慢性临床感染期,并最终导致免疫系统的崩溃[1]。艾滋病抗病毒治疗(ART)是目前唯一有效干预手段[A,B],早期对患者实施ART可能会增加免疫功能复常率,且加速免疫重建,但临床和生物学的研究结果显示[2],ART治疗时间对临床愈后及HIV/RNA愈后是影响在评估治疗益处与短期和长期相关并发症、治疗成本方面仍存在争议,因此,治疗有效的前提必须有完善的治疗依从性[C]。国外的研究结果显示[D]:HIV/RNA监测能提高艾滋病患者治疗依从性。本研究通过对初次接受ART治疗的患者进行定期HIV/RNA检测,分析不同监测时段与患者依从性的关系,找出能提高患者治疗依从性、获得满意治疗效果的一个最佳HIV/RNA监测时机,为指导临床医师开展ART治疗和为政策开展免费耐药监测提供询证医学依据。
资料与方法
一、一般资料
1.重庆市公共卫生医疗救治中心(重庆市传染病医院,重庆市结核病治疗中心)是重庆市唯一定点治疗艾滋病省级医院,现为重庆市艾滋病医疗治疗控制中心,拥有国内一流的艾滋病病区两个,开设床位100张,专业医师队伍20人,其中主任医师5人,副主任医师5人,硕博士4人,年病人住院量人1578次,门诊量人20121次,是西南地区最大的传染病治疗中心,中心检验科为BSL-2级生物安全实验室,其中艾滋病相关检测实验室获重庆市卫计委生物安全备案,拥有包括:HPLC仪及配套设备、流式细胞仪、紫外可见分光光度计、精密酸度计、超低温冰箱、生物安全柜、超净工作台、超声波清洗机和单向负压引流抽风橱等实验设备设施及全自动病毒载量检测仪。
2.抽取2011年1月至2014年12月在重庆市公共卫生医疗救治中心就诊的HIV确诊实验阳性患者1500人纳入本研究,其中男性901人,女性 599人,年龄最大的64.5岁,最小的18岁,平均年龄46±1.5岁;小学文化程度及以下者163人,初中文化程度412人,高中及中专文化程度429人,大学文化程度(含大专)487人,硕士及以上学历9人。随机分成两组,观测组700人,其中男性429人,女性271人,年龄最大的64.5岁,最小的18.5岁,平均年龄47±2.5岁;小学文化程度及以下者76人,初中文化程度199人,高中及中专文化程度208人,大学文化程度(含大专)213人,硕士及以上学历4人,对照组800人,其中男性472人,女性328人,年龄最大的64岁,最小的18岁,平均年龄46±3.0岁;小学文化程度及以下者87人,初中文化程度213人,高中及中专文化程度221人,大学文化程度(含大专)274人,硕士及以上学历5人,两组在性别、年龄、文化程度比较,差异无统计学意义,P>0.05
二、方法
1.分组方法:纳入病例随机分成两组,对照组予以每年1次HIV/RNA监测,观察组予3,6,12个月及以后以每半年1次HIV/RNA监测,两组患者均予以ART治疗前常规HIV/RNA,并做好基线统计
2.治疗方法:按照标准一线治疗方案[3]予以ART治疗:3TC+AZT/TDF+EFV/NVP。(3TC:拉米夫定,AZT :齐多夫定,TDF: 替诺福韦,EFV :依非韦伦,NVP 奈韦拉平),其它机会性感染根据并且对症对因综合治疗。
3.实验室及辅助检测:
3.1实验室检测:初始ART治疗前,予以血尿常规、肝肾功、电解质、血糖、淀粉酶、乙肝/丙肝标志物、梅毒,CD4及HIV/RNA基线检测,HIV/RNA监测按照分组要求在不同时段进行监测。
3.2辅助检查:每月一次X光、B超、EKG,必要时CT检查。
3.3 HIV/RNA监测主实验室方法: HIV-1 RNA病毒载量测定采用罗氏公司生产的全自动病毒载量仪器及配套的HIV-1检测试剂盒;T淋巴细胞亚群计数(流式细胞检测仪)采用美国BD公司生产的仪器FACSCa1ibur与三色试剂CD3/CD4/CD8:
4.研究纳入及排除标准:
4.1纳入标准:①HIV确诊试验阳性(蛋白印迹法(WB));②CD+4≤500拷贝/ml; ③18≤年龄≤65岁;④初始ART治疗,既往未有ART治疗史;⑤经过依从性教育已做好了服药准备;⑥轻度肝肾功能异常经治疗转氨酶复常可纳入本研究;= 7 \* GB3⑦充分了解本研究的前提下,自愿接受本研究治疗方案治疗及检测,并签署知情同意书。
4.2 排除标准:①HIV确诊试验阴性性(蛋白印迹法(WB))或HIV确诊试验阳性但CD+4>500拷贝/ml;②年龄>65岁或<18岁;③已经ART治疗;④肝功能异常(ASK、ALT超过正常上限1.2倍及、或HbsAg、HbeAg和HbcAg同时阳性者);⑤慢性肾病及肾功能异常,;⑥糖尿病血糖控制不佳者(空腹血糖>7.0mmol/L或者餐后2小时血糖>11.1 mmol/L); ⑦合并有心脑血管、肾脏、造血系统等严重原发性疾病,消化道溃疡病,或影响其生存的严重疾病(如肿瘤); ⑧妊娠、准备妊娠或哺乳期妇女;⑨精神或法律上的残疾患者。
5治疗效果评判指标:根据HIV/RNA监测结果结合CD4、卡罗斯基积分、症状体征总积分、感冒次数、体质量等进行综合评估。
6、依从性评判标准:国内外专家共识,必须大于95%以上的服药准时性,才能够有效果。否则,必定耐药。
7.统计学方法:采用SPSS17.0统计软件,计数资料用率表示,均数(`x±S),采用χ2检验及精确概率法进行比较.
表1 纳入研究病例基线调查表(`x±S)%
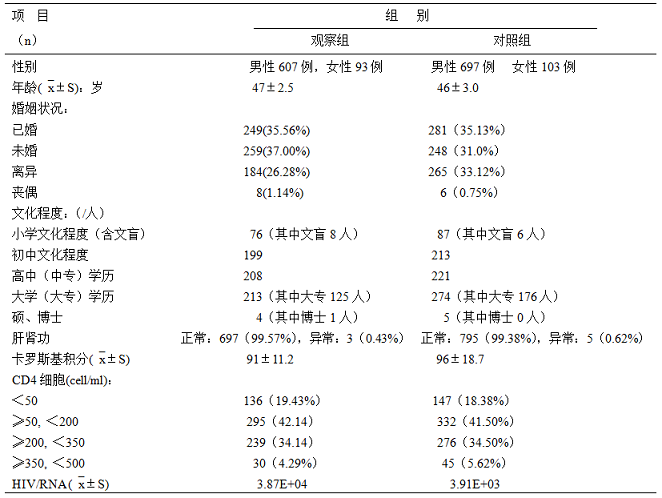
注:E:对数据级单位,1E=101,,3.87E+04为:3.87×104
结 果
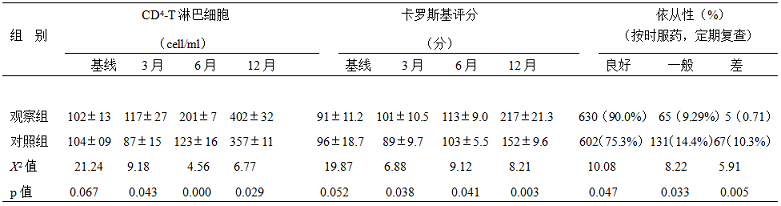
1.两组患者1年内各时段CD4 HIV/RNA平均值、卡罗斯基计分及1年后依从性比较:对照组CD4-T淋巴细胞分别在ART治疗第3,6,16月实验室检测的平均值为(87±15)、(123±16)、(357±11);卡罗斯基评分:(01±10.5)、(113±9.0)、(217±21.3),治疗1年后依从性评判,良好:602(75.3%)一般:131(14.4%)差:67(10.3%);观察组CD4-T淋巴细胞分别在ART治疗第3,6,16月实验室检测的平均值为117±27,201±7,402±32,卡罗斯基评分:101±10.5 113±9.0 217±21.3,治疗1年后依从性评判,良好:630(90.0%),一般:65(9.29%),差:5(0.71)。观察组各时段的CD4对照组比较,P值分别为0.043、0.000、0.029,差异有统计学意义,观察组各时段卡罗斯基评分与对照组比较,P值分别为0.038、0.041、0.003,差异有统计学意义;ART治疗1年后,观察组依从性良好及依从性差较对照组比较,P值分别为0.047、0.005,差异有统计学意义,见表2.
表2:两组一年内各时段CD4、卡罗斯基积分及1年后依从性比较(`x±S)%
2. 两组患者不同时段的HIV/RNA监测值及治疗效果比较:按照课题设计,观察组予以基线HIV/RNA监测,然后第3,6,12,以后每半年监测一次,对照组除基线监测外,每年监测一次HIV/RNA,比较两组患者RAT治疗期间不同时段治疗效果及HIV/RNA监测值比较。结果显示:
表3:两组患者HIV/RNA、症状体征总积分、耐药发生率等比较(`x±S)%
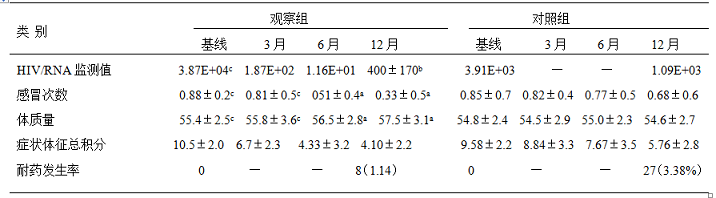
试验组分别治疗6、12月后与CD4及HIV/RNA平均基数值、卡罗斯基计分、机会性感染比较:试验组CD4在ART治疗6、12月后较基线97cell/ml分别升高52.58%(46/97)、262.89%(255/352);HIV/RNAART治疗6、12月后较基线4588分别降低到167、19;ART治疗6、12月后,机会性感染由初始的16%(24/150),分别降为14%(21/150)、2.0%(3/150),治疗6个月后CD4及HIV/RNA与基线比较有统计学意义,P<0.05,而卡罗斯基评分两者比较无统计学差异,P >0.05,治疗12个月后CD4及HIV/RNA与基线比较有统计学意义,P<0.01,卡罗斯基评分两者比较有统计学差异,P <0.05,见表2.
两组在基线(初始)、ART治疗6、12月后比较无统计学差异,P>0.05
3.两组ART治疗6、12月后CD4、HIV/RNA与患者治疗效果的关系:以试验组为例,结果显示:两组ART治疗6个月,机会性感染发病率与初始治疗时差别不大,分别为12%(18/150)、14%(21/150);ART治疗12个月后则分别迅速降为2.67%(4/150)、2.0%(3/150),因此,ART治疗6个月为关键时间节点,以试验组见表3.
讨 论
艾滋病与结核病特别是耐药结核病等同为世界性公共卫生问题[5],感染HIV后,大约三分之二的病人会出现急性逆转录病毒综合征的一些症状,而大约三分之一的病人无症状,艾滋病病毒感染后因迅速拷贝破环人体免疫系统且无特效根治性药物,目前,ART治疗是唯一有效控制艾滋病进程的干预手段[6],近年来,国内外在ART治疗的药物研发、治疗手段、干预措施等有了长足的发展,但各种原因导致的耐药成为艾滋病防治棘手的问题。因此,耐药监测成为治疗艾滋病防治耐药最为有效的监测手段。
艾滋病病毒主要破坏人体免疫系统中的CD4:+-T淋巴细胞,继而达到人体免疫系统的崩溃,早期积极的ART治疗可有效阻止或阻断这一进程,本研究表2显示, 两组ART治疗6、12月后CD4值均有不同程度的提升,Breton的研究结果表明[7],抑制性受体影响HIV-Ⅰ特异性CD4:+和CD8+T细胞程序性凋亡因子(PD)-1,从而导致其肌体功能衰竭。然而,CD4:+和CD8+T细胞在ART治疗初期变化幅度较大,且受免疫重建综合征影响而使得这一指标不能完全作为判断ART治疗的金标准[8],本研究病例均为初始ART治疗者,CD4检测值易受多方面影响而出现假性升高甚至短时期内达到正常,给临床医师带来误判。自从2009年来,缺乏关于CD4细胞计数较高时启动治疗及应用ART治疗的风险研究数据因而发达国家不再以CD4细胞计数多少来作为是否ART治疗的标准,而大样本国际性随机START研究证实了这个观点[9]。
近年来,越来越多的学者认为,判断ART治疗的效果,除了免疫指标CD4:+和CD8+T细胞等更应与病载结合,尽管治疗中可能出现免疫重建综合症而导致CD4:+和HIV/RNA矛盾,但临床上更应注重HIV/RNA监测,目前HIV/RNA被临床认为判断ART治疗效果最有效而可靠的指标[10]。此外,国内外研究还认为HIV/RNA监测是作为加强依从性最好的手段。一项荟萃分析系统评价了病毒载量监测作为一种加强依从性手段的相关研究[11],而国内刘彦春等[12]等人的研究结果同样证实了这点。
CD4-T淋巴细胞及HIV/RNA检测在ART治疗特别是初次治疗时的临床意义已得到共识,但在CD4-T淋巴细胞及HIV/RNA监测下何时启动ART治疗尚无定论,研究显示[13]:在确诊后24周一旦考虑其它协变量,CD4-T淋巴细胞计数与死亡进展无关,但一般说来,CD4-T淋巴细胞计数仍是一个重要的愈后评估指标,但需结合HIV/RNA。综合表2,3,本研究显示,在有CD4-T淋巴细胞及HIV/RNA监测下尽可能早期开展ART治疗,而且,最初治疗的6个月是关键节点,因患者机会性发生率与初始治疗前差别不大,加之出现药物副作用,易对患者服药依从性造成影响,这也是ART治疗的一个拐点,南非的一项研究表明[14],早期接收ART治疗且能顺利坚持服药6月以上的感染者或病人,5年生存率提高了10个百分点(93%比83%).
综上,本研究基本与国外研究一致,但如同其它学者类似问题的研究一样[15],存在以下问题:一是本次荟萃分析的资料均为公开发表并可在全文中获得完整数据的文献,但高质量、大规模、多中心、长时间随机对照的数量偏少,二是荟萃分析的质控标准不统一,研究过程中易出现偏移现象,即作者不愿提供阴性结果或无结论之研究的一种倾向,这是荟萃分析的局限性,三是目前RCT论文中对安全性报告都不到位,应如实报告安全性问题以综合了解研究的获益情况
参考文献:
[1] Zetola NM, Pilcher CD, et al. Diagnosis and management of acute HIV infection. Infect Dis Clin North Am. 2007, 21(1): 19-48.
[2] Cohen MS, Chen YQ, McCauley M, et al. Prevention of HIV-1 infection with early antiretroviral therapy. N Engl J Med. 2011, 365(6): 493-505.
[3] Ryom L, Mocroft A, Kirk O, et al. Association between antiretroviral exposure and renal impairment among HIV-positive persons with normal baseline renal function: the D:A:D Study. J Infec Dis. 2013, 207(9): 1359-69.
[4] Jadad AR, Moore RA, Carroll D, et al. Assessing the quality of reports of randomized clinical trials: is blinding necessary?
Control Clin Trials. 1996, 17(2): 1-12.
[5] Falzon D, Jaramillo E, Schünemann HJ, et al. WHO guidelines for the programmatic management of drug-resistant tuberculosis: 2011 update. Eur Respir J. 2011, 38(3): 516-28.
[6] WHO.Tuberculosisi care with TB-HIV co-management: intergrated management of adolescent and adult illness(IMAI). 2007.
[7] Breton G,Chomont N, Takata H, et al. Programmed death-1 is a marker for abnormal distribution of naive/memory T cell subsets in HIV-1 infection. J Immunol. 2013, 191(5): 2194-204.
[8] Chen,T, Ding EL, Seage Lii GR, et al. Meta-analysis: increased mortality associated with hepatitis C in HIV-infected presons is unrelated to HIV disease progression. Clin Infect Dis. 2009, 49(10): 1605-15.
[9] Simon C, et al. Why the “when to start” question is complex and informed by limited evidence:a response to Dr Myron.
May 2013, HTB South. http://i-base.info/htb-south/2341
[10] Drak JW, et al. Rates of spontaneous mutation among RNA viruses. Proc Natl Acad Sci USA. 1993, 90(9): 4171-5.
[11] Bonner K, Mezochow A, Robert T, et al. Voral load monitoring as a tool to reinforce adherence: a systematic review. J Acquir Immune Defic Syndr. 2013, 64(1): 74-8.
[12]刘彦春,李杏红,李兴旺,等.690例HIV/AIDS 首诊病例的临床特征与免疫状态和病毒载量相关性研究.中华流行病学杂志,2007,28(10):1026-1029.
[13] Van Sighem Al, Gras LA, Reiss P, et al. Life expectancy of recently diagnosed asymptomatic HIV-infected patients approaches that of unInfected individuals. AIDS. 2010, 24(10): 1527-35.
[14] Walensky RP, Ross EL, Kumarasamy N, et al. Cost-effectiveness of HIV treatment as prevention in serodiscordant couples. N Engl J Med. 2013, 369(18):1715-25
[15]许超,江先洲,张念昭,等.索利那新与托特罗定用于治疗膀胱过度活动症安全性的荟萃分析.中华医学杂志,2012,92(48):3398-3402.


