作者:何伟1,石啸双1,张知云1,宿杨帅1,万红叶1,王毅1,喻晓春1,2,朱兵1,景向红1
(1 中国中医科学院针灸研究所,北京 100700;2 中国针灸学会)
[摘 要] 回顾针灸对呼吸系统和全身免疫炎性反应调控的影响,探讨神经免疫调控对控制炎性反应的可能作用途径以及胆碱能抗炎通路治疗新型冠状病毒肺炎(简称“新冠肺炎”)的作用途径。针灸可能通过胆碱能抗炎通路等途径 对新冠肺炎发挥局部和全身抗炎效应。与体液抗炎通路相比,神经抗炎通路启动早,作用迅速,更局限化,在炎性反应的初始关键阶段起着更重要的作用,这可能是新冠肺炎早期进行针灸干预的重要依据。除了胆碱能抗炎通路,针灸还可能通过激活交感神经、下丘脑-垂体-肾上腺轴等神经抗炎通路发挥抗炎效应。针灸在炎性反应的不同时期如何通过躯体刺激激活迷走和交感神经等通路来发挥作用,是否依赖于穴位的选择、刺激的方式等,这将是针灸基础向临床转化研究的方向。
[关键词] 新型冠状病毒肺炎;针灸;炎性反应;神经免疫调节
Discussion on the effect pathways of preventing and treating coronavirus disease 2019 by acupuncture and moxibustion from the regulation of immune inflammatory response
HE Wei1, SHI Xiao-shuang1, ZHANG Zhi-yun1, SU Yang-shuai1, WAN Hong-ye1, WANG Yi1, YU Xiao-chun1,2, ZHU Bing1, JING Xiang-hong1 (1Institute of Acupunture and Moxibustion, China Academy of Chinese Medical Science, Beijing 100700, China; 2China Association of Acupunture-Moxibustion)
KEYWORDS :coronavirus disease 2019(COVID-19); acupuncture and moxibustion; inflammatory response; neuroimmune regulation
2019 年底,新型冠状病毒肺炎(coronavirus disease2019, COVID-19,简称“新冠肺炎”)在中国特别是武汉市肆虐,几万人感染。在此次中西医结合抗击新冠肺炎过程中,针灸专家积极参与,推出多种针灸预防和治疗新冠肺炎的方案,有些团队已经开展临床研究注册。中国针灸学会也推出了《新型冠状病毒肺炎针灸干预的指导意见(第二版)》[1]。目前各方案主要是依据传统针灸理论对该病进行分析,困于目前的研究现状,高质量的临床证据和科学研究的决策还不够。新近发表于《柳叶刀》的 1 篇文献[2]分析了早期感染的 41 例患者炎性因子水平,发现新冠肺炎患者血浆白介素(interleukin,IL)-1β、IL-7、IL-8、IL-9、IL-10、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)含量均高于健康人。重症监护室(intensive care unit,ICU)组患者血浆 IL-2、IL-7、IL-10 和 TNF-α等浓度比非ICU组更高,而且 ICU 患者可能在短时间内发生了“细胞因子风暴”,和病情加重密切相关。采取有效的治疗手段在疾病初期抑制炎性因子的升高,阻断其向“炎症风暴“的发展,是治疗新冠肺炎的重要途径。本文将从针灸对呼吸系统疾病的免疫调节和神经免疫调控机制探讨针灸治疗新冠肺炎的思路。
1 针灸对呼吸系统和全身免疫炎性反应的调控
1.1针灸对呼吸系统免疫炎性反应的调控
针灸可以通过调节免疫炎性反应缓解支气管哮喘。支气管哮喘的本质是一种慢性呼吸道炎性疾病, T 淋巴细胞及其亚群,淋巴细胞分泌的各类炎性介质、细胞因子皆参与其中。针灸疗法可平衡 T 淋巴细胞亚群,减少与炎性反应密切相关的细胞因子分泌,减轻支气管炎性反应,减轻哮喘症状[3-7]。针刺对于过敏性鼻炎也有很好的疗效,过敏性鼻炎是由多种细胞因子和免疫活性细胞参与的血清免疫球蛋白 E(IgE)介导的Ⅰ型变态反应性疾病,其中嗜酸性粒细胞、肥大细胞及 T 淋巴细胞在整个过程起到明显作用。同样,调控T 细胞亚群及其相关炎性因子也是针灸治疗过敏性疾病重要的细胞免疫机制[8-10]。
1.2针灸对全身免疫炎性反应的调控
针刺可能通过调控免疫炎性反应,改善脓毒症患者的预后。针灸作为辅助手段用于脓毒血症的治疗, 相比标准治疗,针刺足三里可以更早纠正细胞因子IL-6 的异常升高,升高 CD +、CD + T 细胞,改善胃肠功能,降低脓毒血症引起的 28 d 死亡率[11-12]。Meta 分析[3]显示,联合针刺疗法可以减轻脓毒症患者全身炎性反应,促进机体功能恢复,改善临床症状和预后。
1.3针灸可以改善患者的免疫功能
已有研究[13]证实,针灸可以调节巨噬细胞、中性粒细胞、天然杀伤细胞、淋巴细胞、免疫球蛋白功能及补体的活性。免疫功能低下可造成 T 淋巴细胞数量的改变和 T 细胞亚群的紊乱,而针灸可改善淋巴细胞亚群紊乱,调节机体免疫,从而改善患者机体状态。针灸可以提高易感冒患者的血清 IL-2 水平而预防感冒[14]。针刺还能改善女性焦虑患者体内巨噬细胞的吞噬功能、淋巴细胞的增殖作用以及自然杀伤细胞的活性[15]针刺也可以作为癌症患者的辅助治疗,调节癌症患者的细胞因子水平,调整 Th1/Th2 平衡,在一定程度上增强患者的免疫功能[16]。
2 炎性反射与神经免疫调节
神经系统和免疫系统二者的相互作用对于免疫和炎性反应的调节至关重要。2002 年,Tracey[17]研究发现中枢神经系统对外周炎性反应可产生“反射性调节”,首次提出“炎性反射”的概念。迷走神经传入支感受炎性反应局部升高的细胞因子或者其他炎性因子,将炎性反应信息传递至迷走神经结状神经节,并将免疫炎性信号以神经冲动形式向中枢传递、整合。与炎性反射相关的中枢脑区有孤束核(nucleus tractus solitarius,NTS)、最后区(area postrema,AP)和迷走背核,这 3 个区域构成了背侧迷走神经复合体(dorsal vagal complex,DVC),经过中枢整合,激活自主神经系统或下丘脑 垂体 肾上腺(hypothalamic-pituitary- adrenal,HPA)轴,实现对炎性反应的调控作用。
2.1胆碱能抗炎通路
胆碱能抗炎通路( cholinergic anti-inflammatory pathway,CAP)是炎性反射的传出通路,通过传出迷走神经末梢释放乙酰胆碱,与巨噬细胞和其他免疫细胞上的α7n 型乙酰胆碱受体(α7 subunit nicotinic acetylcholine receptorα7,nAChR)结合,抑制网状内皮系统的组织巨噬细胞活化,进而抑制巨噬细胞释放促炎因子如 TNF-α,IL-1β,IL-6 等,其对抗炎因子并不发挥直接的作用[18]。CAP 是中枢神经系统利用胆碱能神经元与递质对机体炎性反应起到一定抑制作用的神经调节通路,广泛参与炎性反应的免疫调节,近年来受到广泛关注,也成为外周内脏器官保护的一个热点。
2.2交感神经的炎性反应调节
炎性信号通过 NTS 投射到延髓头端腹外侧区(rostral ventrolateral medulla,RVM)-蓝斑核(locus coeruleus,LC),再通过 RVM、LC 投射到脊髓交感节前胆碱能神经元。交感神经节后神经末梢释放的去甲肾上腺素和肾上腺髓质释放的肾上腺素,通过与淋巴细胞和巨噬细胞等免疫细胞表达的β2-肾上腺素受体相互作用发挥抗炎作用。交感神经在炎性反应调节中起着双重作用,同时介导促炎和抗炎效应[19]。实际上,迷走神经和交感神经以拮抗,协作和接替等方式实现对炎性反应的神经调节[20]。如交感神经的激活通过 α2-肾上腺素受体介导导致肿瘤坏死因子合成的上调[19, 21],但是迷走神经的激活可以抵消肿瘤坏死因子的过度释放[18]。
2.3中枢下丘脑-垂体-肾上腺轴的炎性反应调节
炎性反应信号通过迷走传入神经同 NTS-下丘脑室旁核(paraventricular nucleus,PVN)神经发生联系, 激 活中枢 HPA 轴,释放内源性 糖皮质激素(glucocorticoid,GC),通过神经内分泌途径,发挥抗炎效应。GC 是神经内分泌反应系统的终末效应点,通过结合于细胞内受体,抑制促炎性细胞因子(如 TNFα、IL-1、IL-8 等)的合成,并激活抗炎性细胞因子(如IL-4,IL-10)的合成,来降低炎性反应[22]。
与体液抗炎通路相比,神经抗炎通路有以下特点[23]:①启动早。如同控制心率等其他生命体征一样,神经系统也实时监控着免疫系统。小剂量的内毒素或炎性介质信号通过激活胆碱能抗炎通路,而体液抗炎通路则需要大剂量的免疫刺激信号[18]。②作用迅速。神经免疫通路借助于神经信号,其传导作用迅速,而体液调节因子依赖于浓度梯度发挥作用较缓慢分散。③更局限化。由于神经活动作用范围有限,神经抗炎效应也更局限化,对内脏靶器官作用更加精准。此外由于神经传导具有不应期,其控制生物功能是短暂的, 如没有进一步的信号输入,免疫细胞就能快速恢复功能。因此,与体液抗炎途径相比,神经抗炎通路能够快速、直接地调节炎性因子的产生和释放。基于以上特点,神经抗炎通路在炎性反应的初始关键阶段起着更重要的作用。
Photo by Pixabay from Pexels
3 胆碱能抗炎通路对肺炎的作用
CAP 的调节作用在急性肺炎的多种动物模型中得到了验证[24],CAP 的激活也影响到急性肺炎涉及的多种细胞和信号通路。对于轻症的肺炎患者,激活迷走胆碱能抗炎通路,可以起到快速的抗炎作用。在经典胆碱能抗炎通路中,迷走神经与脾神经被认为两者必不可少,但是这种观点受到了一定的质疑,主要原因是还没有找到迷走神经与脾神经的解剖学联系的确切证据[23]。有作者提出了一种新的不依赖于脾的肺副交感炎性反射的模型:分布于肺底和肺泡的传入神经感受机械,化学,生物或其他刺激,将信息上传至位于脑干的 NTS,最后通过肺迷走神经的传出支分泌乙酰胆碱,作用于巨噬细胞、单核细胞和其他免疫细胞上的α7nAChR,从而抑制炎性反应,或者通过核因子κ B(NF-B)通路作用于肺上皮细胞,调节促炎因子的表达。因此,可以推测,迷走神经可能通过局部的迷走-迷走炎性反射和经典的 CAP[25],发挥对肺炎的局部和全身性的抗炎作用。
4 针灸激活胆碱能抗炎通路
有关腧穴脏腑相关或体表内脏相关的研究[26]表明,体表穴位信息通过脊髓-孤束核-迷走背核来发挥对内脏功能的调节作用。该研究用刺激孤束核逆行激动大鼠脊髓背角细胞的方法,在腰骶髓背角第ⅢⅤ 层观察到逆向反应细胞,提示孤束核作为内脏感觉核, 还接受从脊髓来的体感信息。DVC 是内脏功能的调节核团,来自躯体的信息经整合后通过迷走神经下行调节内脏功能,切段迷走神经则体表穴位对胃运动调节的作用消失[27]。电针内关对恶心呕吐的抑制作用是通过抑制脑干最后区 c-fos 的表达并通过激活膈下迷走传出发挥作用[28]。这些研究说明躯体传入有向 DVC的间接投射,并可能激活迷走传出神经来发挥作用。
笔者课题组前期研究[29]表明,耳针和电针“足三里”可以通过胆碱能抗炎通路抑制内毒素血症模型大鼠血清促炎因子 TNF-α、IL-6 的含量。而已有研究[30] 表明,电针“合谷”穴对通过躯体传入激活脑中枢毒蕈碱型乙酰胆受体信号,进而激活传出迷走神经和脾神经发挥抗炎效应,降低内毒素血症模型大鼠 TNF、IL-1β和 IL-6 含量,提高生存率。因此,胆碱能抗炎通路也被认为是针刺抗炎的作用机制之一[31]。
5 针灸激活迷走胆碱能抗炎通路为治疗新冠肺炎提供思路
电针合谷配曲池可以快速降低肺炎所致脓毒血症患者的体温,减轻炎性反应,可能与刺激迷走神经而激活胆碱能抗炎通路及升高乙酰胆碱、胆碱乙酰转移酶水平有关[32]。针刺“足三里”激活胆碱能抗炎通路缓解家兔肺缺血再灌注引起的肺损伤[33]。由于目前分科限制,呼吸系统疾病起病急,转变快,针灸治疗肺炎等这类呼吸系统疾病的临床报道还非常少。大多数针灸对于免疫的调节临床研究多是在如前所述的慢性疾病,如变应性鼻炎、哮喘等。
由于迷走神经传入引起的神经免疫抗炎通路具有起效快,作用直接的特点,故其在炎性反应的初始关键阶段就可以发挥作用。此次新冠肺炎,80%以上的患者为轻症和普通型[34],针刺通过激活迷走神经经胆碱能抗炎通路来发挥抗炎作用(见图 1),为新冠肺炎的早期治疗提供了一定思路。对于重症患者,由于“细胞因子风暴”可导致多器官的损伤,激活迷走神经可以对内脏器官如心、肝、肾、肺、脑、胃肠的保护作用[35]。因此对于重症患者针灸也可以作为一种辅助治疗手段,发挥多脏器保护作用。
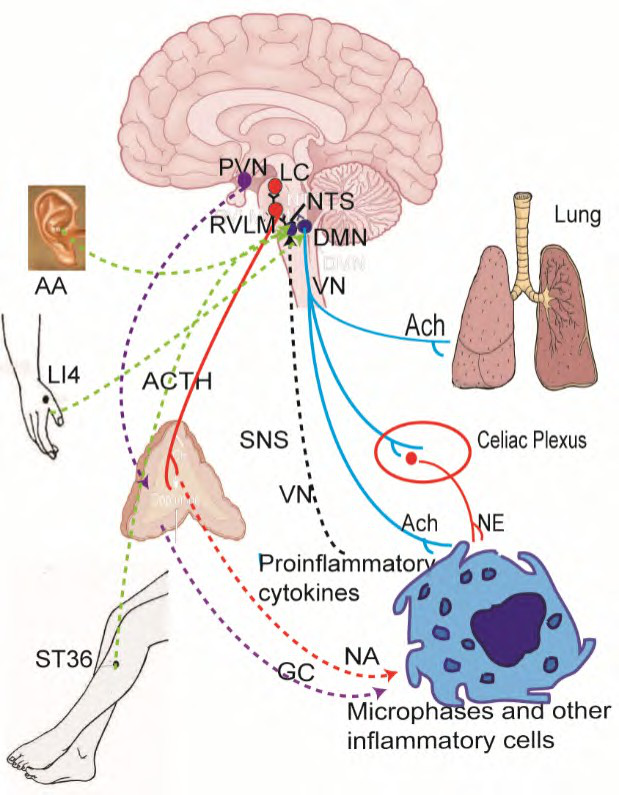
注:针灸信号通过躯体传入神经上传到迷走复合体相关核团孤束核(NTS)、迷走神经背核(DMN),最后区(AP),经 NTS 至交感神经中枢如延髓头端腹外侧核(RVLM),蓝斑核(LC)及下丘脑室旁核(PVN),激活自主神经系统和下丘脑-垂体-肾上腺轴(HPA)轴,释放或分泌乙酰胆碱(Ach)、去甲肾上腺素(NE)、肾上腺素(NA)和糖皮质激素(GC)等神经相关激素和递质,作用于炎性细胞,发挥局部和全身的抗炎效应。
图 1 针灸激活神经免疫抗炎可能的作用途径
中国针灸学会《新型冠状病毒肺炎针灸干预的指导意见(第二版)》[1]提出针灸干预用于新冠肺炎的早期治疗,其机制可能就在于通过节段性交感神经反射, 其节后纤维末梢释放的去甲肾上腺素与淋巴细胞和巨噬细胞等免疫细胞表达的β2-肾上腺素受体结合发挥抗炎作用;并在迷走神经介导的系统性胆碱能抗炎通路参与下,协调对肺炎的双重免疫调控,达到减少炎性反应的目的。
神经免疫调节是机体内源性调节系统,包括了对先天免疫和获得性免疫的调节。在炎性反应发病过程中,迷走神经和交感神经如何协同发挥抗炎作用,确实是一个新领域。针灸对神经免疫的调控,也是多年来的研究热点。同时,笔者注意到,针灸通过对神经免疫的调节来控制炎性反应,促进机体修复,这一调节需要结合机体状态,给予适宜刺激,促进机体自稳态的调控,达到治疗疾病的目的;针灸激活胆碱能抗炎通路,对内脏器官具有保护作用,在疾病的恢复期对受损器官起到修复作用。具体到临床要解决的是, 明确针灸在炎性反应的不同时期如何通过躯体刺激激活迷走和交感神经而发挥作用,是否依赖于穴位的选择、刺激的方式等,这将是针灸基础向临床转化研究的方向。
参考文献
[1]中国针灸学会. 新型冠状病毒肺炎针灸干预的指导意见(第二版) [J/OL]. 中国针灸. (2020-03-04) [2020-03-05]. https://doi.org/10. 13703/j.0255-2930.20200302-k0009.
[2]Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet, 2020, 395(10223): 497-506.
[3]王丽娟, 李健, 李小娟. 针刺疗法治疗脓毒症临床疗效和安全性的 Meta 分析[J]. 中医药导报, 2018, 24(23): 86-90..
[4]李孟媛, 王朝辉, 王洪峰. 针刺治疗支气管哮喘机制的研究进展[J]. 上海针灸杂志, 2018, 37(10): 1116-1120.
[5]张智龙, 吉学群, 薛莉, 等. 针刺治疗支气管哮喘急性发作期临床观察[J]. 中国针灸, 2005, 25(3): 158-160.
[6]董宗祈. 小儿过敏性哮喘的发病机制及其治疗[J]. 实用儿科临床杂志, 2000, 15(3): 174-176.
[7]韩艾. 针刺对支气管哮喘患者细胞免疫功能的影响[J]. 中国中医急症, 2000, 9(5): 187-188, 186.
[8]Baars EW, Savelkoul HFJ. Citrus/cydonia comp. can restore the immunological balance in seasonal allergic rhinitis-related immunological parameters in vitro[J]. Mediators Inflamm, 2008, 2008: 496467.
[9]兰建华, 罗雪梅, 曾友根, 等. 针刺穴位治疗变应性鼻炎对患者血清 IL-2 及 IFN-γ 的影响[J]. 中国医学创新, 2016, 13(20): 97-99.
[10]王琳娜, 冯纬纭. 壮医莲花针背廊拔罐法对变应性鼻炎患者血清 Th1/Th2 细胞平衡的影响[J]. 广西中医药, 2015, 38(4):59-61.
[11]吴凡伟. 电针刺激足三里穴对脓毒证患者炎症反应和免疫功能的影响[J]. 中国中医急症, 2016, 25(9): 1794-1797.
[12]虞意华, 金肖青, 俞迈红, 等. 针灸对老年严重脓毒症患者胃肠功能及胃肠激素影响的临床研究[J]. 中华中医药学刊, 2015, 33(8): 1953-1956.
[13]Yamaguchi N, Takahashi T, Sakuma M, et al. Acupuncture regulates leukocyte subpopulations in human peripheral blood[J]. Evid Based Complement Alternat Med, 2007, 4(4): 447-453.
[14]杨力强, 邓柏颖, 李晓红, 等. 化脓灸对感冒易感患者白细胞介素-1β 水平的影响[J]. 江苏中医药, 2009, 41(1): 50-51.
[15]Arranz L, Guayerbas N, Siboni L, et al. Effect of acupuncture treatment on the immune function impairment found in anxious women[J]. Am J Chin Med, 2007. 35(1): 35-51.
[16]林国华, 林丽珠, 张英, 等. 火针四花穴对晚期非小细胞肺癌化疗患者 Th1/Th2 免疫平衡和功能状态的影响[J]. 针刺研究, 2019, 44(2): 136-139.
[17]Tracey KJ. The inflammatory reflex[J]. Nature, 2002, 420(6917): 853-859.
[18]Pavlov VA, Wang H, Czura CJ, et al. The cholinergic anti-inflammatory pathway: a missing link in neuroimmunomodulation[J]. Mol Med, 2003, 9(5-8): 125-134.
[19]Elenkov IJ, Wilder RL, Chrousos GP, et al. The sympathetic nerve--an integrative interface between two supersystems: the brain and the immune system[J]. Pharmacol Rev, 2000, 52(4): 595-638.
[20]Ulloa L, Quiroz-Gonzalez S, Torres-Rosas R. Nerve Stimulation: Immunomodulation and Control of Inflammation[J]. Trends Mol Med, 2017, 23(12): 1103-1120.
[21]Zhou M, Yang S, Koo DJ, et al. The role of Kupffer cell alpha(2)-adrenoceptors in norepinephrine-induced TNF-alpha production[J]. Biochim Biophys Acta, 2001, 1537(1): 49-57.
[22]McEwen BS, Milner TA. Hippocampal formation: shedding light on the influence of sex and stress on the brain[J]. Brain Res Rev, 2007, 55(2): 343-355.
[23]Pavlov VA, Tracey KJ. Neural regulators of innate immune responses and inflammation[J]. Cell Mol Life Sci. 2004, 61(18): 2322-2331.
[24]Su X, Lee JW, Matthay ZA, et al. Activation of the alpha7 nAChR reduces acid-induced acute lung injury in mice and rats[J]. Am J Respir Cell Mol Biol, 2007, 37(2): 186-192.
[25]宋娜娜, 刘俊, Moldoveanu B, 等. 迷走神经与肺部疾病(英
文)[J]. 复旦学报(医学版), 2012, 39(2): 117-122.
[26]吕国蔚. 经穴脏腑相关的现代实验研究[J]. 神经解剖学杂志, 2016, 32(1): 113-118.
[27]Li YQ, Zhu B, Rong PJ, et al. Neural mechanism of acupuncture-modulated gastric motility[J]. World J Gastroenterol, 2007, 13(5): 709-716.
[28]Li S, Lei Y, Chen JDZ. Chemotherapy-Induced Pica in RatsReduced by Electroacupuncture[J]. Neuromodulation, 2018, 21(3):
254-260.
[29]Zhao YX, He W, Jing XH, et al. Transcutaneous auricular vagus nerve stimulation protects endotoxemic rat from lipopolysaccharide-induced inflammation[J]. Evid Based Complement Alternat Med, 2012, 2012: 627023.
[30]Song JG, Li HH, Cao YF, et al. Electroacupuncture improves survival in rats with lethal endotoxemia via the autonomic nervous system[J]. Anesthesiology, 2012, 116(2): 406-414.
[31]Kavoussi B, Ross BE. The neuroimmune basis of anti-inflammatory acupuncture[J]. Integr Cancer Ther, 2007, 6(3): 251-257.
[32]王硕, 李丽娜, 齐文升, 等. 大肠经原合配穴电针治疗肺炎所致脓毒症的效果及其对胆碱能抗炎通路的影响研究[J]. 实用心脑肺血管病杂志, 2018, 26(8): 66-69.
[33]苏跃. 胆碱能抗炎通路对家兔肺缺血再灌注损伤的影响[D].北京: 北京市结核病胸部肿瘤研究所, 2007.
[34]高钰琪.基于新冠肺炎病理生理机制的治疗策略[J/OL]. 中国病理生理杂志. (2020-03-03)[2020-03-06]. http://kns.cnki.net/kcms/ detail/44.1187.R.20200302.1432.004.html.
[35]马莉, 冷玉芳, 张梦婕, 等. 胆碱能抗炎通路对器官的保护研究进展[J]. 兰州大学学报(医学版), 2020, 46(1): 10-15.


