美国吉利德公司研发的抗病毒药物瑞德西韦(remdesivir),已经停止了在中国的两项临床试验。
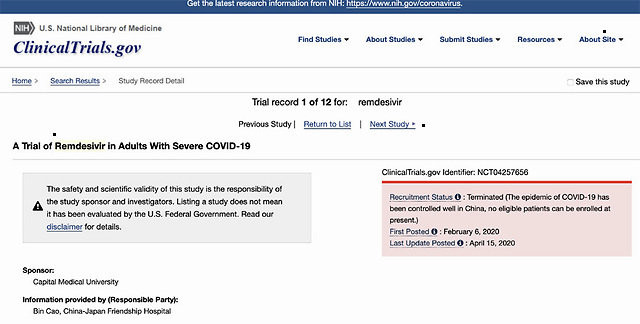
临床试验网站ClinicalTrials.gov,瑞德西韦在中国的新冠肺炎成人重症试验状态为“终止”,原因显示为:“中国的新冠肺炎疫情已经得到良好控制,当前没有符合条件的患者入组。”
同时,瑞德西韦在中国的新冠肺炎成人轻症和中度症状组的临床试验状态也已更新为“暂停”,原因显示为:“当前,新冠肺炎疫情已得到良好控制,没有符合条件的患者入组。”
吉利德在新型冠状病毒肺炎高发的国家开展了两项瑞德西韦的三期临床研究,名为SIMPLE研究。据吉利德官网显示,由于入组人数低,在中国进行的两项临床试验已提前终止。由美国国家过敏和传染病研究所(NIAID)领导一项瑞德西韦的全球性研究仍在招募患者,该研究的数据预计在5月公布。此外,基于世界卫生组织(WHO)的主研究方案,包括瑞德西韦在内的新型冠状病毒肺炎在研疗法的更多研究,也已开始在世界各国进行患者入组。
4月11日,吉利德在顶级期刊《新英格兰医学杂志》(NEJM)上宣布了一项队列分析的结果,数据针对53名新型冠状病毒肺炎严重并发症的住院患者,他们以个例同情用药的方式,接受了在研抗病毒药物瑞德西韦的治疗。
首次使用瑞德西韦后18天的中位随访期内,68%接受瑞德西韦治疗的患者(n=36/53)的氧气支持水平得到改善。57%需要机械通气的患者可以拔管(n=17/30),47%在接受瑞德西韦治疗后出院(n=25/53)。总死亡率为13%(n=7/53)。
在安全性方面,总计32名患者(60%)出现副作用,最常见的是肝脏酶指标升高、腹泻、皮疹、肾功能障碍和高血压。总计12名(23%)患者出现严重副作用,其中包括多器官多器官功能障碍综合征、败血性休克、急性肾脏损伤和高血压。
上述试验,同情用药数据存在局限性,因为用药队列的规模小,随访时间相对较短,同情用药的性质本身可能导致数据丢失,且缺乏随机对照组。
瑞德西韦目前尚未在全球任何国家获得批准,对于治疗新型冠状病毒肺炎的安全性或有效性尚不明确。



