肺癌是世界上最常见的恶性肿瘤之一。基因突变是非小细胞肺癌发生发展和转移的重要因素。KRAS突变是非小细胞肺癌中最主要的基因突变之一,近年来针对KRAS G12C抑制剂的开发取得了突破性进展,但是针对KRAS其它突变如KRAS G12D等仍缺乏有效的靶点药物。
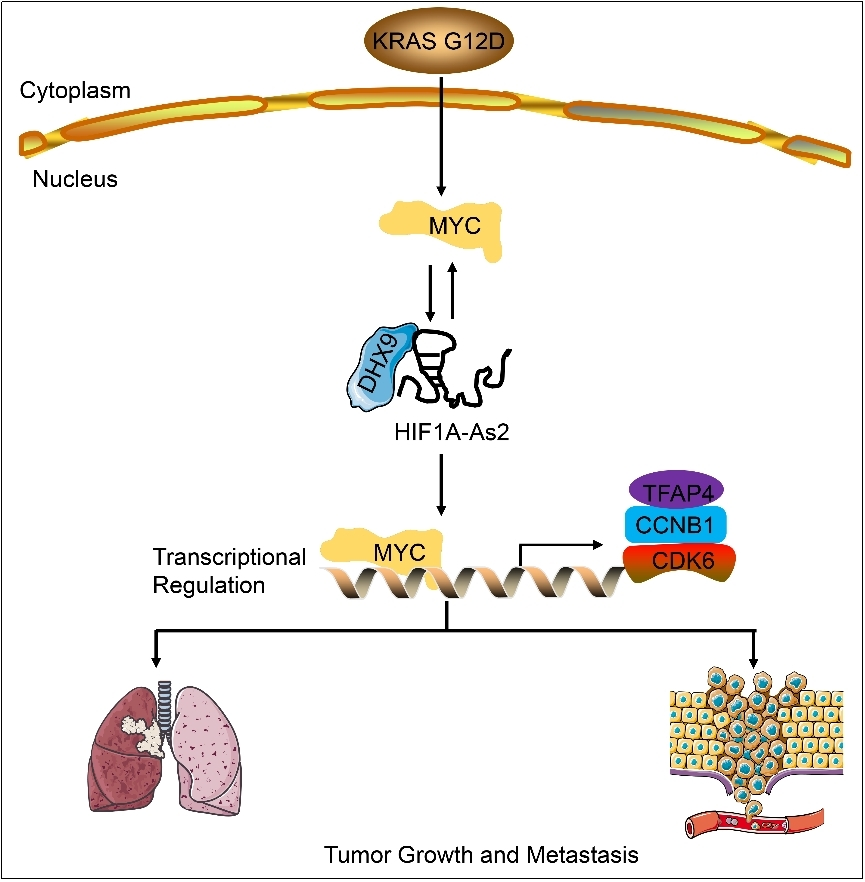
研究结果模式图。课题组供图
近日,兰州大学公共卫生学院教授石磊团队在《细胞死亡与分化》发表研究成果,揭示了lncRNA HIF1A-As2与MYC形成双向调控环路,促进KRAS G12D诱导的非小细胞肺癌发生发展和转移,为研究lncRNA在肿瘤中的作用机制提供新的思路,为非小细胞肺癌的诊断和治疗提供新的靶点,具有重要的理论意义和医学价值。
通过RNA-seq,团队发现KRAS调控的80条lncRNA中,HIF1A-As2上调幅度最大。通过TCGA(The Cancer Genome Atlas)数据分析,发现HIF1A-As2在肺癌组织表达明显高于正常组织,并且与细胞增殖和肿瘤发生息息相关。近来,有文献报道HIF1A-As2可以促进在非小细胞肺癌耐药性和肿瘤发生发展。但是在已发表论文中,HIF1A-As2主要作为microRNA海绵分子参与肿瘤发生发展,在其它层面的分子机制仍不清楚,尤其在非小细胞肺癌中的生物学功能和分子调控机理也有待阐释。
通过RAP-MS(RNA Antisense Purification Mass Spectrometry)和CLIP(Cross-linking RNA Immunoprecipitation)实验,课题组初步筛选出HIF1A-As2结合蛋白质DHX9。DHX9,又名RHA(RNA Helicase A),主要参与DNA复制、转录调控、RNA运输和microRNA生物合成等多项生物学功能。通过RNA-seq、RT-qPCR等方法,课题组发现HIF1A-As2不调控邻近基因(顺式调控),主要调控远端基因,揭示了其反式调控基因表达的功能。通过GSEA(Gene Set Enrichment Analysis)和GO(Gene Ontology)功能分析,课题组发现HIF1A-As2参与转录调控,与MYC通路密切相关。课题组进一步发现,HIF1A-As2通过招募DHX9到MYC启动子,从而激活MYC转录调控,影响下游基因表达,促进细胞增殖和转移。此外,MYC可以结合在HIF1A-As2区域,从而转录后激活HIF1A-As2的表达水平。综上,HIF1A-As2和MYC形成双向反馈环路,促进肿瘤发生发展。
最后通过PDX动物模型,课题组发现HIF1A-As2 antisense oligonucleotide(ASO)联合MYC小分子抑制剂,可以有效抑制肿瘤增长;通过KRASLSLG12D诱导小鼠模型,HIF1A-As2 ASO可以增强机体对Cisplatin的敏感性,抑制肿瘤转移。
来源:中国科学报 温才妃 法伊莎
相关论文信息:https://doi.org/10.1038/s41418-023-01160-x
● END ●
渔歌临床招募平台癌症患者招募,全国各地有中心,涵盖前沿靶向药、抗体偶联药物(ADC)、PD-1/PD-L1免疫疗法、CAR-T细胞疗法、双特异性抗体疗法、免疫联合靶向疗法……
点击下方,了解更多临床试验项目。



