细胞疗法是人类攻克肿瘤道路上攀登的一座新高峰,被认为是继手术、放射疗法、化疗和靶向疗法之后的新疗法。2024年2月16日,FDA加速批准名为lifileucel的TIL疗法用于PD-1/PD-L1治疗后进展的晚期黑色素瘤。这是全球首款获批治疗实体瘤的T细胞疗法,代表了细胞疗法在实体瘤治疗方面的一个重要里程碑。
● 什么是TIL疗法? ●
TIL(肿瘤浸润淋巴细胞)疗法是一种基于细胞的免疫治疗方法,它利用患者自身肿瘤微环境中的免疫细胞来识别和攻击癌细胞。以下是TIL疗法的一般流程:
1. 肿瘤组织采集:从患者的实体瘤中手术切除肿瘤组织,这些组织中含有已经识别并试图攻击肿瘤的淋巴细胞。
2. TIL细胞分离:在实验室中,将肿瘤组织进行分解,分离出肿瘤中的淋巴细胞。
3. 体外培养与扩增:分离得到的TIL细胞在体外通过特定培养基和细胞因子(如白细胞介素2,IL-2)进行培养和大量扩增。
4. TIL细胞筛选:进行肿瘤特异性识别检测,筛选出能够对肿瘤更具特异性杀伤的TIL细胞。
5. 淋巴清除化疗:在TIL细胞回输前,患者可能需要接受化疗,以清除体内正常的淋巴细胞,为TIL细胞提供一个有利的体内环境。
6. TIL细胞回输:将扩增后的TIL细胞通过静脉输注的方式输回患者体内,以增强对肿瘤的攻击。
7. 监测和评估:TIL细胞输注后,医疗团队将密切监控患者的生理反应和治疗效果,评估TIL细胞对癌细胞的攻击效果,并管理可能出现的副作用。
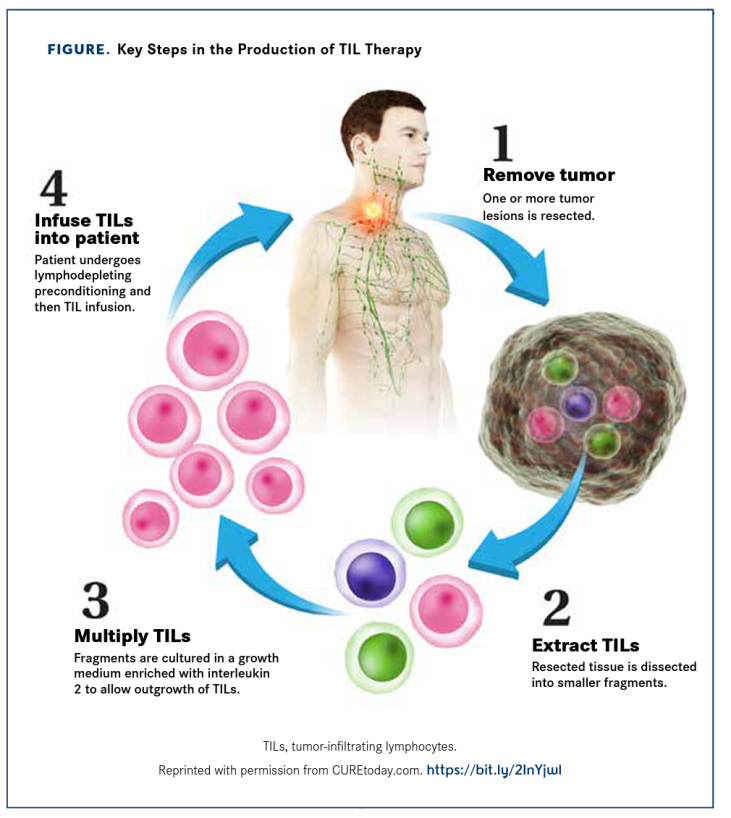
TIL疗法关键流程
TIL疗法的关键在于其高度个性化的治疗方法,使用患者自身的免疫细胞,为每位患者定制治疗方案。TIL疗法在治疗黑色素瘤方面取得了显著的进展,并且在宫颈癌、结直肠癌、胆管癌、非小细胞肺癌和乳腺癌中也显示出了初步疗效。TIL疗法相比CAR-T疗法在实体瘤治疗领域具有独特优势,例如TIL细胞具有多克隆T细胞受体(TCR)多样性,能够识别多种肿瘤抗原,包括肿瘤特异性的新抗原,从而更有效地应对肿瘤的异质性。此外,TIL细胞来源于患者自身,无需基因修饰,具有较低的毒性和免疫原性。
尽管TIL疗法展现出巨大潜力,但其生产过程复杂、成本高昂,且需要高度专业化的实验室设施和技术人员。TIL疗法也面临一些挑战,包括如何提高TIL细胞的制备效率、降低成本、改善T细胞的功能以及如何更好地重塑肿瘤微环境以提高治疗效果。随着研究的深入和技术的改进,TIL疗法有望为更多实体瘤患者提供新的治疗选择。
● 和CART疗法有什么区别? ●
CAR-T疗法和TIL疗法都是免疫细胞疗法的重要组成部分,但它们在治疗机制、应用范围和生产过程等方面存在明显差异。
1. 治疗机制:
- CAR-T疗法:通过基因工程技术,将特定的嵌合抗原受体(CAR)导入患者的T细胞中。这些改造后的T细胞能够识别癌细胞表面的特定抗原,并发起免疫攻击。
- TIL疗法:直接从患者的肿瘤组织中提取肿瘤浸润淋巴细胞(TIL),这些细胞已经具备识别肿瘤的能力。在体外扩增后,再输回患者体内,以增强对肿瘤的攻击。
2. 应用范围:
- CAR-T疗法主要应用于某些类型的血液癌症,如B细胞急性淋巴性白血病(ALL)和非霍奇金淋巴瘤(NHL)。
- TIL疗法则主要针对实体瘤,尤其是对传统治疗方法反应不佳的晚期实体瘤患者。
3. 生产过程:
- CAR-T疗法涉及复杂的基因编辑过程,技术要求高,成本较高。
- TIL疗法虽然也需要细胞培养和扩增,但目前不涉及遗传改造,技术流程相对简单。
4. 治疗效果和副作用:
- CAR-T疗法在血液瘤治疗中显示出超过90%的完全缓解率,但在实体瘤治疗中效果有限。
- TIL疗法在实体瘤治疗中展现出巨大潜力,尤其是黑色素瘤,但其生产过程复杂、成本高昂。
5. 个性化程度:
- CAR-T疗法虽然是针对特定抗原设计的,但不同患者之间的CAR-T细胞设计可能相似。
- TIL疗法则是高度个性化的,因为它们直接来源于患者的肿瘤组织,具有个体化的肿瘤特异性。
6. 研究和临床应用:
- CAR-T疗法已经有几款产品获得FDA批准上市,用于治疗某些血液瘤。
- FDA已批准一种名为lifileucel的TIL疗法,用于治疗PD-1/PD-L1治疗后进展的晚期黑色素瘤,显示出良好的疗效。
综上所述,CAR-T和TIL疗法各有优势和局限性,它们在癌症治疗领域中发挥着互补的作用。随着研究的深入,这两种疗法都有望为更多类型的癌症患者提供新的治疗选择。
渔歌临床招募平台癌症患者招募,全国各地有中心,涵盖前沿靶向药、抗体偶联药物、PD-1/PD-L1免疫疗法、CAR-T细胞疗法、双特异性抗体疗法、免疫联合靶向疗法……




